La Administración Nacional de supervisión de productos alimenticios y farmacéuticos ha aprobado un total de 48 nuevos productos para la prueba de la Corona (reactivos + instrumentos + programas informáticos) y ha publicado 410 nuevas listas blancas de exportaciones de corona.
Al 13 de julio de 2020, la Organización Mundial de la salud (OMS) había aprobado a nivel mundial 15 nuevos productos de prueba de la Corona.La FDA ha aprobado autorizaciones de emergencia para 137 nuevos productos de prueba de la Corona en todo el mundo.La Administración Nacional de supervisión de productos alimenticios y farmacéuticos ha aprobado un total de 48 nuevos productos de prueba de la Corona (reactivos + instrumentos + programas informáticos) y la Cámara de salud ha publicado una lista blanca de 410 nuevas exportaciones de corona.
Dos empresas nacionales que cotizan en el IVD han sido acreditadas por la nmpa, la OMS, la EU y la FDA.
Según las estadísticas, en la actualidad hay en el país dos empresas de diagnóstico in vitro y in vitro que están acreditadas o autorizadas por la Administración Nacional de fiscalización de drogas (nmpa), la administración de supervisión de alimentos y medicamentos de los Estados Unidos (FDA) y la Organización Mundial de la salud (OMS).
La FDA ha sido acreditada por la FDA.
Entre las empresas transnacionales acreditadas por la Organización Mundial de la salud (OMS) y la FDA EUA figuran las conocidas de Danah (saipei, Beckmann), Roth, Abbott, Siemens y perkinelmer.
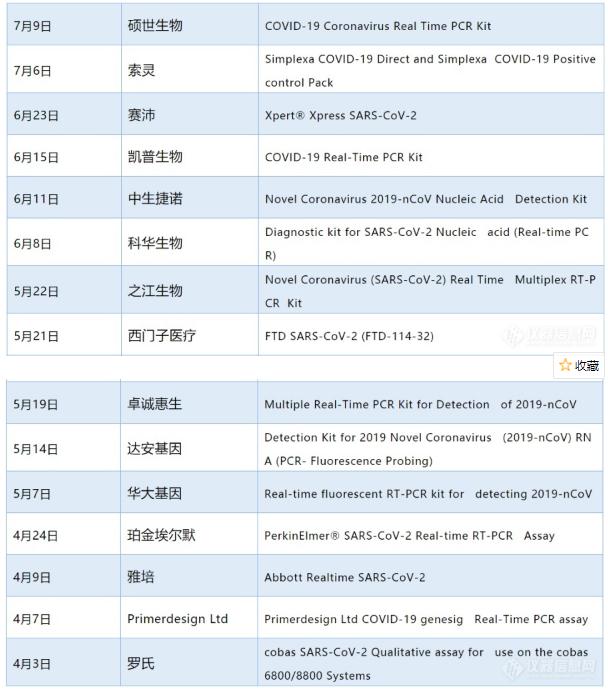
15 nuevos productos de prueba de la Corona incluidos en la lista de la OMS EUL
Hay ocho empresas nacionales e internacionales de diagnóstico que figuran en la lista de la Organización Mundial de la salud (OMS) EUL, a saber, las de la familia Seok, la criatura Kep, el Jeno medio, la criatura Kova, la criatura Zhijiang, la criatura Zhuang, la familia Zhuang, el gen daean y el gen Hua.
Entre las empresas extranjeras figuran Roth, Abbott Laboratory, perkinnamer, Pepsi Cola, Siemens, souling, etc.
A continuación figura la lista (en orden cronológico):
Autorización para el uso urgente de 137 nuevos productos de prueba de la Corona
La aprobación por la FDA de nuevos productos para la prueba de la Corona de China ha aumentado considerablemente a medida que la epidemia de la nueva Corona de los Estados Unidos sigue aumentando considerablemente.En la actualidad, la FDA ha aprobado 137 nuevos productos de prueba de la Corona para su uso urgente, y hay más de 10 empresas de diagnóstico en el país y en el extranjero.Cabe señalar que los resultados de las empresas de Hangzhou son más visibles.
Algunas empresas nacionales están autorizadas a:
Beijing wantai biopharmaceuticals Co.
Fecha de ratificación: 10 de julio
Producto aprobado: detección rápida de vantasar - COV - 2ab
Hangzhou anxu Biotechnology CO.
Fecha de ratificación: 6 de julio
Producto aprobado: dispositivo de detección rápida assure kovid - 19 IgG / IGM
Hangzhou Lai & Biotechnology CO.
Fecha de ratificación: 19 de junio
Producto aprobado: kit de prueba de combinaciones de anticuerpos IgM / IgG para el nuevo virus coronario Lyle (2019 nkov)
Larga vida
Fecha de ratificación: 18 de junio
Producto aprobado: kovid - 19
Hefei bio - Technology Co.
Fecha de ratificación: 18 de junio
Producto aprobado: kits de ensayo de anticuerpos biohit SARS - COV - 2 IGM / IgG
Beijing Wangdu Gene Technology Co.
Fecha de ratificación: 5 de junio
Producto aprobado: genetron SARS - COV - 2 ARN
Hangzhou botu Biological Technology Co.
Fecha de ratificación: 4 de junio
Producto aprobado: Caja de detección rápida rightsign - kovid - 19 IgG / IGM
Oriental Biology (All - ownership America hengsheng Biotechnology CO.
Fecha de ratificación: 29 de mayo
Producto aprobado: Caja de pruebas rápidas Covic - 19 IgG / IgM (sangre entera / suero / plasma)
Shenxiang Biological Technology Co.
Fecha de ratificación: 4 de mayo
Producto aprobado: Caja de diagnósticos de ácido nucleico del nuevo virus coronario (2019 nkov)
Organismos de Antón
Fecha de ratificación: 24 de abril
Producto aprobado: detección rápida del SARS - COV - 2
Productos farmacéuticos
Fecha de ratificación: 17 de abril
Producto aprobado: kit de reactivos multiestrella kovid - 19 RT - PCR
Biología, Mike.
Fecha de ratificación: 15 de abril
Producto aprobado: estuche de reactivos de SARS - COV - 2 fluorescentes PCR
Criaturas de corvis
Fecha de ratificación: 6 de abril
Producto aprobado: kits de ensayo gmomegen kovid - 19 RT - digital PCR
Beijing genómica Institute
Fecha de ratificación: 26 de marzo
Producto aprobado: estuche de reactivos RT - PCR en tiempo real para la detección de SARS - COV - 2
Antígenos, anticuerpos, aproximadamente el 20%.
De los 137 nuevos productos de la Corona aprobados por la FDA - EUA, los de ácido nucleico son los principales, alrededor del 80%.Los antígenos y los análisis de anticuerpos representaron alrededor del 20%.
Las principales empresas autorizadas para realizar pruebas de anticuerpos son:
Beckmann Coulter, Roth, Abbott, osido, antulias, Aumont, Siemens, BD, Eastern, Rahab, biota, biota, biota, biogen, Korean Science and Technology, diazyme Laboratories, Inc.Imbo International Ltd.- Babson Diagnosis.El laboratorio médico Emmerich, el laboratorio clínico dinámico de los Estados Unidos, el laboratorio Mount Sinaí, etc.
Las principales empresas autorizadas para la detección de antígenos son:
El 2 de julio, la FDA aprobó la bidi - BD & 39; el sistema de detección rápida SARS - COV - 2, un método portátil de detección inmediata del antígeno Covic - 19, disponible en un plazo de 15 minutos.Se sabe que este es el tercer producto de prueba de la Corona aprobado por la empresa BD.
El 8 de mayo, la FDA aprobó el antígeno Sofia 2sar FIA de la empresa quidel, que era la primera vez que la FDA aprobaba el antígeno.



Teléfono de la compañía: +86 18930727028
E-mail: Contáctenos
Teléfono móvil: +86 18930727028
Sitio web: zhibei.spab2b.com
Dirección: Room 1603, Building 26,Lane 100,Chujia Road, Qingcun Town, Fengxian District, Shanghai, China